高中化学 专题一 微观结构与物质的多样性 第一单元 核外电子排布与元素周期律(第1课时)原子核外电子排布与元素周期律习题 苏教版必修2.doc
高中化学 专题一 微观结构与物质的多样性 第一单元 核外电子排布与元素周期律(第1课时)原子核外电子排布与元素周期律教案 苏教版必修2.doc
高中化学 专题一 微观结构与物质的多样性 第一单元 核外电子排布与元素周期律(第1课时)原子核外电子排布与元素周期律课件 苏教版必修2.ppt
高中化学 专题一 微观结构与物质的多样性 第一单元 核外电子排布与元素周期律(第1课时)原子核外电子排布与元素周期律素材 苏教版必修2.doc
高中化学 专题一 微观结构与物质的多样性 第一单元 核外电子排布与元素周期律(第1课时)原子核外电子排布与元素周期律学案 苏教版必修2.doc
共1个课件,4份文档。
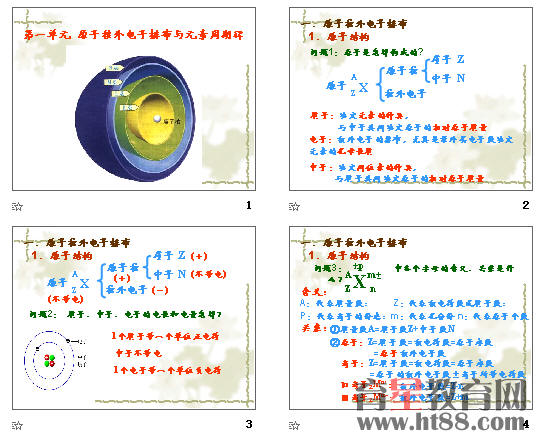
原子核外电子排布
课题 专题一第一单元原子核外电子排布 课型 新授课
课标
要求 1.知道元素、核素、同位素、质量数的涵义。
2.了解原子核外电子的排布。
3.能画出1~18号元素的原子结构示意图。
教
学
目
标 知识与能力 了解1-18号元素核外电子排布及相应的规律,并能用原子结构示意图表示上述元素的核外电排布。
过程与方法 掌握原子核外电子排布规律,通过1-18号元素的原子和离子结构示意图的学习,扩展到主族元素的电子排布规律的认识,初步体会归纳与演绎的学习方法。
情感、态度与价值观 通过原子核外电子排布规律,了解物质运动的复杂性和特殊性
教学
重点 准确画出1—18号元素原子结构示意图
应用原子核外电子排布的规律解决问题
原子核外电子排布
【学习目标】
1.了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示原子(离子)的核外电子排布
2.培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工
【重点、难点】
(一)知识上重点、难点:构成原子的微粒间的关系和核外电子排布规律。(二)方法上重点、难点:培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
【自主学习】
(这部分内容要求同学们根据下面提示预习,课前独立完成,记下不明白的问题,课堂上交流讨论)
(请同学们回忆一下我们曾经学过的原子结构示意图有关知识,阅读P2图1-1和图1-2归纳原子的结构和性质)
1.写出钠原子结构示意图的各部分名称
1.1.1 原子核外电子的排布
一、选择题(本题包括5个小题,每小题4分,共20分)
1.不符合原子核外电子排布基本规律的是()
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
【解析】选D。第n电子层最多可容纳的电子数为2n2个。
A.m>n B.0<n<10
C.m=10-n D.m<4
【解析】选D。金属单质能够和盐酸反应生成可燃性的氢气,其最外层电子数为1~3。
3.下列各微粒中,各个电子层电子数都达到2n2个的是()
A.Ne、Ar B.Al3+ 、S2-
C.F- 、Na+ D.Ne、Cl-
【解析】选C。Ar、S2- 和Cl- 都有三个电子层,最外层(第三层)都只有8个电子,没有达到2×32=18个。
1.1.1 原子核外电子的排布
【典例1】(2010•嘉兴高一检测)有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是________________;
(2)画出B元素原子的结构示意图________________ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式________________ ;
A的氢氧化物和D的氢氧化物反应的离子方程式
________________ 。





资源评论
共有 0位用户发表了评论 查看完整内容我要评价此资源