醇的性质与 应用导学案.doc
醇的性质和应用 课件设计.ppt
共1个课件,1份学案。
醇的性质与应用导学案
【学习目标】
1.认识醇的组成及结构特点
2.理解醇的性质,了解醇的化学性质及用途
3.从乙醇的组成、结构上认识有机化合物发生反应时的断键方式,了解反应条件对有机化学反应的影响
4.了解常见的醇在日常生活中的应用及对环境造成的影响。
第一课时
【观察与思考】根据课本图4-6,归纳出醇与酚在结构上的不同点
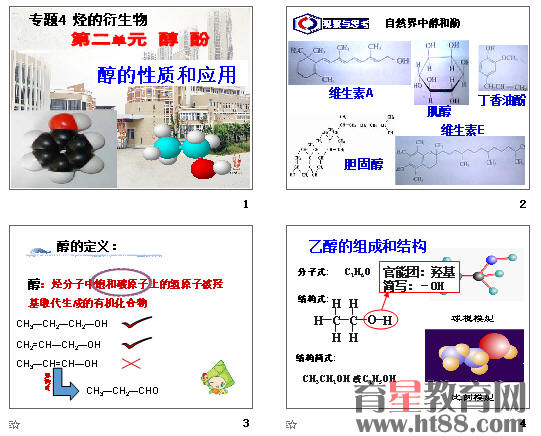
一、醇的概念:
【以乙醇为例学习醇的性质】
乙醇的结构和组成
乙醇的分子式:
乙醇的结构式:
乙醇的结构简式:
乙醇的官能团:
乙醇的物理性质
颜色:色透明
气味:特殊味
状态:通常情况下为体
密度:比水,200C时的密度是0.7893g/cm3
溶解性:跟以任意比互溶,能够溶解多种无机物和有机物
挥发性:挥发
乙醇的化学性质
【交流与讨论】
我们已经学习过乙醇的一些性质。请与同学交流你所知道的乙醇的化学性质,试列举乙醇发生的化学反应,并指出在反应过程中乙醇分子中的哪些化学键发生了断裂?
根据以上这些反应中乙醇分子化学键发生断裂的情况可以得出什么结论?
二、醇的化学性质
(一)取代反应
1、
2、
【活动与探究(一)】
请设计一实验方案证明乙醇与钠反应的气态产物是氢气。
【活动与探究(二)】
方案:取三支试管,分别加入3mL乙醇、3mL水和3mL乙醚,再分别向三支试管中放入一小块金属钠,观察实验现象
用上面的方案可判断出乙醇与钠反应中乙醇分子中断裂的是氧氢键,而不是碳氢键,其原理是什么?
【实验】
名称 结构式 与钠反应的现象
乙醇
水
乙醚
结论:
【活动与探究(三)】P68实验
【思考与讨论】
1.该实验有什么现象?
2.油状物可能是什么,如何验证?
3.试管Ⅱ和烧杯中的水的作用分别是什么?
结论:3.
【练习】写出下列反应的化学方程式
1.乙醇与金属钾的反应
2.乙二醇与金属钠的反应
3.2-丙醇与HCl的反应
参考答案
【观察与思考】
醇的概念:烃分子中饱和碳原子上的氢原子被羟基取代生成的有机化合物。
乙醇的结构和组成
乙醇的分子式:
乙醇的结构式:
乙醇的结构简式:
乙醇的官能团:羟基简写:-OH
乙醇的物理性质
颜色:无色透明
气味:特殊香味
状态:通常情况下为液体
密度:比水小,200C时的密度是0.7893g/cm3
溶解性:跟水以任意比互溶,能够溶解多种无机物和有机物
挥发性:易挥发
乙醇的化学性质
【交流与讨论】
反应的化学方程式
(1)乙醇与乙酸的酯化反应





资源评论
共有 0位用户发表了评论 查看完整内容我要评价此资源