《离子晶体》ppt19
- 资源简介:
共53张。讲练结合,含配套教案,约3240字。
第三章第四节离子晶体
内容分析:
学生具备了离子键、离子半径、离子化合物等基础知识,本节直接给出氯化钠、氯化铯晶胞,然后在科学探究的基础上介绍影响离子晶体结构的因素,通过制作典型的离子晶体模型来进一步理解离子晶体结构特点,为学习晶格能作好知识的铺垫。
课时划分:
一课时。
教学目标:
1.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
2.知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关。
3.能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别。
教学重点、难点:
了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
教学方法:
分析、归纳、讨论、探究、应用
探究建议:
①制作典型的离子晶体结构模型。②比较氯化钠、氯化铯等离子晶体的结构特征。③实验探究:熔融盐的导电性。④实验探究:明矾或铬钾矾晶体的生长条件。⑤设计探究碱土金属碳酸盐的热稳定性实验方案。⑥查阅资料:晶格能与岩浆晶出规则。
教学过程:
[复习]
1、什么是离子键?什么是离子化合物?
2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?
Na2O NH4Cl O2 Na2SO4 NaCl CsCl CaF2
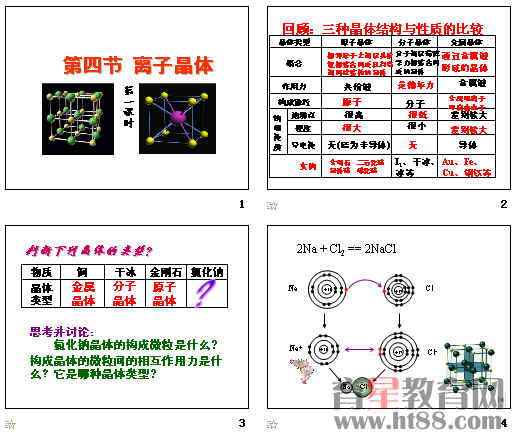
3、我们已经学习过几种晶体?它们的结构微粒和微粒间的相互作用分别是什么?
[过渡]
在晶体中,若微粒为离子,通过离子键形成的晶体为离子晶体,今天我们来研究离子晶体。
[板书]
第三章第四节离子晶体
一、离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
[解析]
(1)结构微粒:阴、阳离子
(2)相互作用:离子键
(3)种类繁多:含离子键的化合物晶体:强碱、活泼金属氧化物、绝大多数盐
(4)理论上,结构粒子可向空间无限扩展
[讨论]
下列物质的晶体,哪些属离子晶体?离子晶体与离子化合物之间的关系是什么?干冰、NaOH、H2SO4 、K2SO4 、NH4Cl、CsCl
[板书]
二、离子晶体的物理性质及解释
[讲述]
在离子晶体中,离子间存在着较强的离子键,使离子晶体的硬度较大、难于压缩;而且,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801℃,沸点为l 413℃;CsCl的熔点为645℃,沸点为l290℃。离子晶体的溶解性有较大差异:如NaCl、KNO3、(NH4)2SO4易溶,BaSO4 、CaCO3难溶。
[板书]
硬度较大、难于压缩、较高的熔点和沸点。
[讲述]
离子晶体种类繁多,结构多样,图3—27给出了两种典型的离子晶体的晶胞。我们来研究晶体中的配位数(在离子晶体中离子的配位数(缩写为C N)是指一个离子周围最邻近的异电性离子的数目)。
[板书]
三、离子晶体中离子键的配位数(C.N.)
1、定义:是指一个离子周围邻近的异电性离子的数目
[投影]NaCl和CsCl的晶胞:
[板书]
2、决定离子晶体结构的主要因素:




资源评论
共有 0位用户发表了评论 查看完整内容我要评价此资源