共19张,主要展示了探究规律、元素周期律、元素周期律探究训练、可用于该内容教学展示。
普通高中新课程化学人教版必修2
第一章物质结构元素周期律
第二节元素周期律(第二课时)
学案
【探究1】同周期主族元素原子半径是否存在递变规律
猜想:我猜想同周期主族元素原子半径从左向右逐渐___________(增大、减小、没有规律),理由是____________________________________________________。
搜集数据:第三周期主族元素原子半径
元素符号 Na Mg Al Si P S Cl
原子半径(nm) 0.186 0.160 0.143 0.117 0.102 0.099
P元素的原子半径可能为:A、0.150 B、0.130 C、0.110
继续搜集数据,并将数据绘成原子半径示意图(右图)
结论:同周期主族元素原子半径从左到右逐渐___________。
反思:影响原子半径的因素包括________________________________________,存在此递变规律是因为_____________________________________________。
【探究2】同周期元素金属性、非金属性强弱比较。以Mg和Al为例比较其金属性强弱。
猜想:我猜想两者金属性强弱关系是____________,理由是_______________________________________________________________________________________。
实验探究一:
Mg Al
实验步骤
实验现象
化学方程式
结论
实验探究二:
Mg Al
实验步骤
实验现象
化学方程式
结论
阅读P16,
Si P S Cl
【探究3】同周期主族元素主要化合价
搜集数据:第三周期元素主要化合价
族 IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
元素符号 Na Mg Al Si P S Cl
最高正价 +1 +2 +3 +4 +6 +7
最低负价 无 无 无 -4 -2 -1
在表中填写P对应的化合价。
结论:第三周期主族元素原子最高正价______________________________________,最低负价_____________________________________________。
总结反思:最高正价、最低负价与族序数关系:____________________________________________________________________________________。
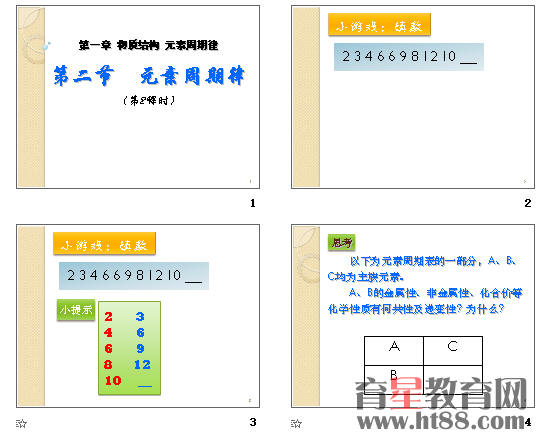
【探究4】体验科学家的研究工作。
现有下列短周期元素性质的一部分数据,请你编排小小元素周期表。
性质 编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径(10-10m) 0.74 1.60 1.86 1.10 0.99 1.52 1.17 0.82
常见化合价 最高正价 +2 +1 +1 +3
最低负价 -2 -3 -1 -4
请确定以上8种元素在周期表中的位置,将元素的编号填入下表中:





资源评论
共有 0位用户发表了评论 查看完整内容我要评价此资源