2017-2018学年高中化学必修一ppt(课件+教案+学案+作业,41份)
- 资源简介:
2017-2018学年高中化学人教版必修1(教案学案作业)
├─2017-2018学年高中化学人教版必修1(教案+ 作业)第1章从实验学化学第2节化学计量在实验中的应用 (打包)
│第2节化学计量在实验中的应用(第1课时)作业.doc
│第2节化学计量在实验中的应用(第1课时)教案.doc
│第2节化学计量在实验中的应用(第2课时)教案.doc
│第2节化学计量在实验中的应用(第2课时)作业.doc
│第2节化学计量在实验中的应用(第3课时)作业.doc
│第2节化学计量在实验中的应用(第4课时)作业.doc
├─2017-2018学年高中化学人教版必修1(教案+学案+作业)第1章从实验学化学第1节化学实验基本方法 (打包)
│第1节化学实验基本方法(第1课时)作业.doc
│第1节化学实验基本方法(第1课时)教案.doc
│第1节化学实验基本方法(第2课时)教案(1).doc
│第1节化学实验基本方法(第2课时)教案(2).doc
│第1节化学实验基本方法(第2课时)学案.doc
│第1节化学实验基本方法(第2课时)作业.doc
│第1节化学实验基本方法(第3课时)作业.doc
├─2017-2018学年高中化学人教版必修1(课件+学案+作业)第3章金属及其化合物第1节金属的化学性质 (15份打包)
│第1节金属的化学性质(第1课时)作业.doc
│第1节金属的化学性质(第1课时)课件.ppt
│第1节金属的化学性质(第1课时)学案.doc
│第1节金属的化学性质(第1课时)作业(2).doc
│第1节金属的化学性质(第2课时)课件.ppt
│第1节金属的化学性质(第2课时)学案.doc
│第1节金属的化学性质(第2课时)作业.doc
│第1节金属的化学性质(第2课时)作业(1).doc
│第1节金属的化学性质(第2课时)作业(2).doc
│第1节金属的化学性质(第3课时)课件.ppt
│第1节金属的化学性质(第3课时)学案.doc
│第1节金属的化学性质(第3课时)作业.doc
│第1节金属的化学性质(第4课时)课件.ppt
│第1节金属的化学性质(第5课时)课件.ppt
│第1节金属的化学性质(第5课时)作业.doc
├─2017-2018学年高中化学人教版必修1(课件+学案+作业)第3章金属及其化合物第3节用途广泛的金属材料 (4份打包)
│第3节用途广泛的金属材料作业.doc
│第3节用途广泛的金属材料课件.ppt
│第3节用途广泛的金属材料学案.doc
│第3节用途广泛的金属材料作业1.doc
└─2017-2018学年高中化学人教版必修1(课件+作业)第3章金属及其化合物第2节几种重要的金属化合物 (9份打包)
第2节几种重要的金属化合物(第1课时)作业.doc
第2节几种重要的金属化合物(第1课时)课件.ppt
第2节几种重要的金属化合物(第2课时)课件.ppt
第2节几种重要的金属化合物(第2课时)作业.doc
第2节几种重要的金属化合物(第2课时)作业(1).doc
第2节几种重要的金属化合物(第2课时)作业(2).doc
第2节几种重要的金属化合物(第3课时)课件.ppt
第2节几种重要的金属化合物(第4课时)课件.ppt
第2节几种重要的金属化合物(第5课时)课件.ppt
第一节 化学实验基本方法
主备人:
知识目标:复习初中相关实验、预习本节内容,让学生获取实验安全方面的知识,加强实验操作能力。
能力目标:加强实验操作能力。
情感态度与价值观:增强学生的实验安全意识,让学生体会到化学实验对学好化学的重要性和注意实验安全对做好化学实验的重要性。
多媒体,PPT,课本
教学重点:增强学生的实验安全意识
教学难点:安全知识
教师活动 学生活动
阐述化学实验对学好化学的重要性和注意实验安全对做好化学实验的重要性。
思考并交流:制取并收集氧气、制取氢气并用氢气还原氧化铜、浓硫酸的稀释三个实验从实验安全的角度要注意哪些问题?为什么要注意这些问题?假如这些问题我们忽视了,容易引起什么后果?
在初中学习化学的过程中,有哪些实验安全问题是要注意的? 思考回答
补充并讲解:在做这几个实验时要注意如下几个问题:
1.无论什么实验,取用化学试剂时不能用手直接去取,固体试剂用镊子、药匙或纸槽取用,液体试剂用量筒、滴管取用或直接倾倒。
2.加热固体时试管口要略低于试管底,若给液体或固液混合物加热则试管口向上,若只有液体则要放碎瓷片。若固体加热易熔化(比如草酸晶体)呢?
3.用排水法收集氧气结束之后应该先撤出导管然后熄灭酒精灯。若制取的是有毒气体则应要注意什么问题?如果用排水法或排空气法收集气体则应采用什么装置?
4.不能用鼻子直接闻气体,酒精灯内酒精的量要适当,不能给燃烧着的酒精灯添加酒精,有气体参加或生成的实验之前要进行气密性检查。
5.点燃(或加热)可燃性气体(如氢气)前要验纯。氢气还原氧化铜之前应先通氢气,待验得氢气纯净后再加热,实验结束之后应先停止加热待试管(玻璃管)冷却后停止通氢气。
6.稀释浓硫酸时要使浓硫酸慢慢沿器壁流入水。在今后的学习中我们还将会遇到浓硫酸与乙醇、浓硝酸等密度比它小的液体的混合,应该如何混合呢?
……
第1节 化学实验基本方法
第1课时 化学实验安全
一、化学实验安全
1.下列实验操作中,主要不是从安全因素考虑的是 ( )
A.用胶头滴管向试管中滴加试剂,滴管不能伸入试管内部
B.给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热
C.给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热
D.用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜
解析:A项用胶头滴管滴加试剂时,胶头滴管要竖直悬空在试管口上方,以防接触到试管,污染试剂;B项试管口应略向下倾斜,外壁干燥后再预热,是防止产生的水蒸气冷凝流向热的试管或试管底部受热不均匀受冷而炸裂;D项应先通一会儿氢气,再加热氧化铜,目的是排除装置中的空气,防止加热时爆炸。
答案:A
2.下列化学药品与其化学危险品图形标志不一致的一组是( )
解析:烧碱是强腐蚀品,不属于爆炸品;甲烷是易燃气体;酒精是易燃液体;白磷能自燃,是易燃固体。
答案:A
3.我们乘车前都要进行安检,易燃、易爆、剧毒、易腐蚀品、强氧化剂等严禁带上车。下列物品可让旅客带上车的是( )
①浓硫酸 ②氰化钾 ③水银 ④汽油 ⑤黑火药 ⑥白磷 ⑦酒精
A.③④⑤⑦
B.①②③④⑤⑥⑦
C.④⑦
D.没有
解析:凡危险品皆不可带上车,上述物品均属危险品。
答案:D
4.下列处理事故的方法不正确的是( )
A.将CO中毒者移至通风处抢救
B.误食硫酸铜溶液,不可服用氢氧化钠溶液解毒
C.不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛
D.氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
解析:A项,将CO中毒者移至通风处,可使其吸入新鲜空气,缓解体内组织缺氧状况;B项,氢氧化钠溶液具有腐蚀性,故不可服用;D项,氢氧化钠浓溶液溅入眼中,立即用大量水冲洗即可。
答案:D
5.进行化学实验必须注意安全,下列说法中正确的组合是( )
①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2
……
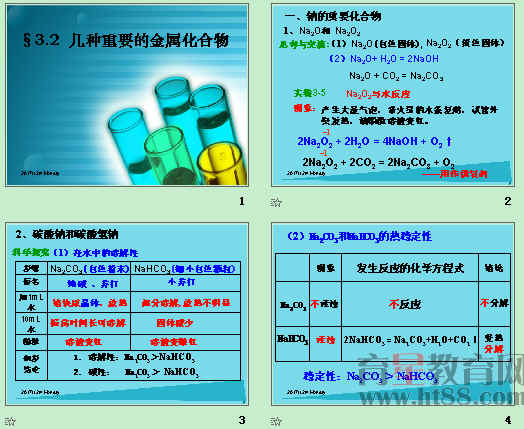
第2节 几种重要的金属化合物
第1课时 钠的重要化合物
一、选择题
1.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
【解析】 Na2O2与水反应时除了生成碱外,还生成了O2,故Na2O2不属于碱性氧化物,故A项错;Na2O2是淡黄色固体,故B项错;Na2O2与CO2和H2O反应时,是Na2O2中的氧元素之间发生了氧化还原反应,CO2、H2O既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原剂,故C项正确;Na2O反应中无氧气产生,不能作供氧剂,D项错误。
【答案】 C
2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
【解析】 氧化还原反应是一个比较慢的过程,而酸碱之间的反应较快。紫色石蕊溶液中加入过量Na2O2粉末,首先会与水反应生成NaOH和H2O2,H2O2部分分解生成O2,生成的NaOH使紫色石蕊溶液变蓝色;由于H2O2有强氧化性,会慢慢将有机色素氧化为无色物质,所以最后溶液变为无色。
【答案】 B
3.下列对于过氧化钠的叙述中,正确的是( )
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.Na2O2与CO2反应时,1 mol Na2O2转移1 mol电子
【答案】 D
4.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )
A.只含Na+
B.一定含Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
【解析】 钠的焰色是黄色,钾的焰色是紫色,观察钾的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰,该实验中没有透过蓝色钴玻璃观察说明一定含Na+,不能确定是否含K+。
【答案】 B
5.现加热5 g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为( )
A.3.38 g B.4.58 g
C.4.16 g D.4.41 g
【解析】 碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有x g NaHCO3,则
2NaHCO3=====△ Na2CO3+CO2↑+H2O Δm
2×84 g 62 g
x g 0.31 g
解之得:x=0.84,
所以m(Na2CO3)=5 g-m(NaHCO3)
=5 g-0.84 g=4.16 g。
【答案】 C
6.有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大
B.等物质的量的Na2CO3和NaHCO3与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
D.Na2CO3溶液和NaHCO3溶液都呈碱性
【解析】 相对分子质量NaHCO3小于Na2CO3,所以等质量的NaHCO3、Na2CO3的物质的量n(NaHCO3)>n(Na2CO3),即产生CO2的体积在相同条件下NaHCO3的大;物质的量相等的NaHCO3、Na2CO3与同浓度的盐酸反应,则消耗盐酸的体积Na2CO3是NaHCO3的两倍;CO2通入饱和Na2CO3溶液中发生反应:CO2+H2O+Na2CO3===2NaHCO3↓,由于溶剂水的质量减少,溶质NaHCO3的质




资源评论
{$comment}